参照元URL : https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
臨床研究法について
臨床研究は、医薬品・医療機器等の開発候補物質が実用化可能かといった開発の探索的研究手段として、重要なものです。また、同種同効薬同士の有効性に関する比較研究や、手術と抗がん剤の組み合わせとの関係で最も効果的な医薬品投与時期の研究など、様々な診療ガイドライン等の検討を行う場面においても臨床研究が実施されています。
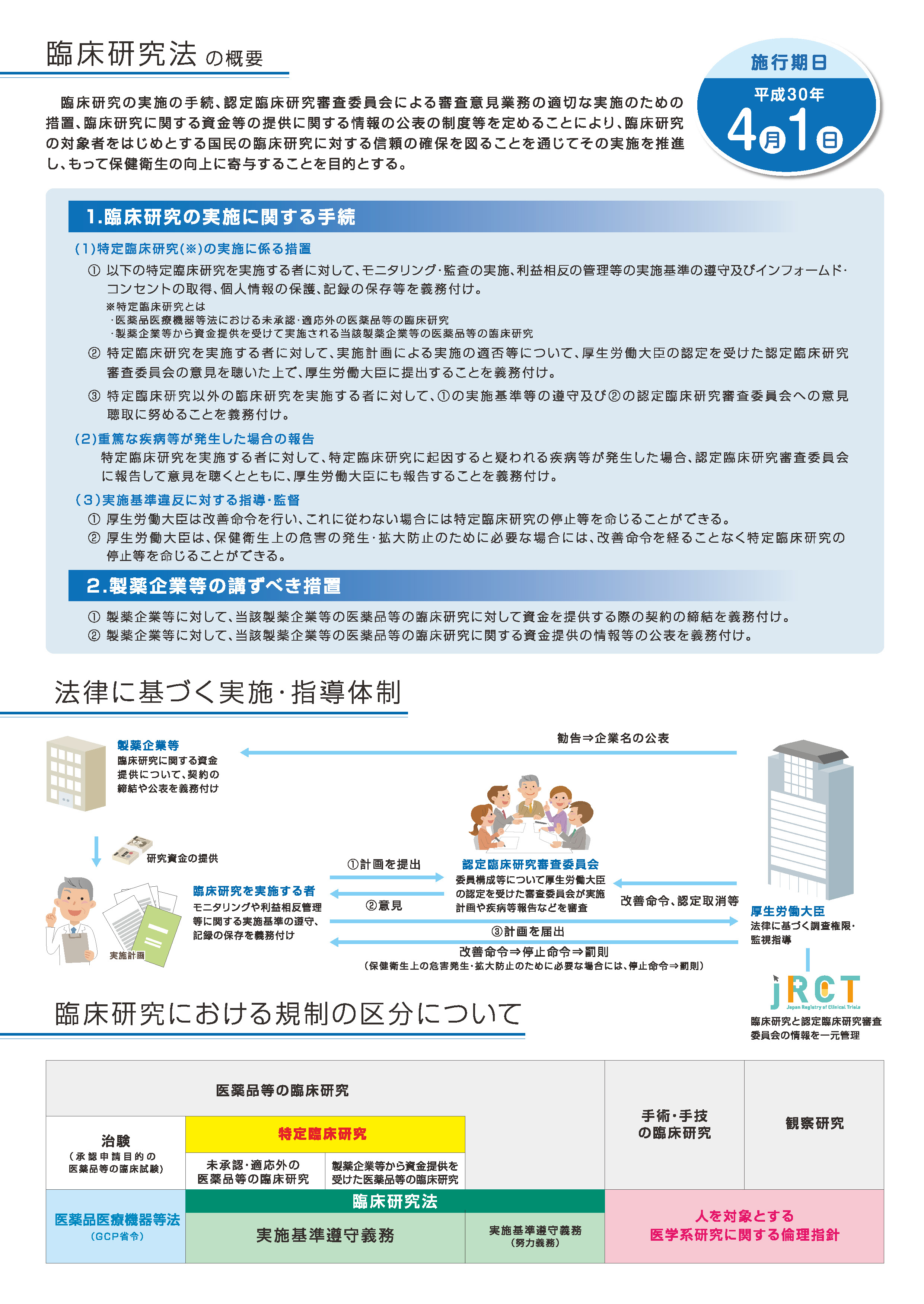
今般、医薬品等を人に対して用いることにより、その医薬品等の有効性・安全性を明らかにする臨床研究を法律の対象とすることとし、臨床研究の対象者をはじめとする国民の臨床研究に対する信頼の確保を図ることを通じてその実施を推進し、もって保健衛生の向上に寄与することを目的として、臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関する情報の公表の制度等を定める「臨床研究法」が平成29年4月に公布されました。
重要なお知らせ
| 2017年04月28日掲載 | 臨床研究法が公布されました(平成29年4月14日) |
|---|---|
| 2018年03月01日掲載 | 臨床研究法施行にあたって、関係の政令、臨床研究法施行規則等が公布されました(平成30年2月28日) |
| 2018年03月05日掲載 | 臨床研究法について、関係の課長通知を発出しました(平成30年3月2日) |
| 2018年03月13日掲載 | 臨床研究法について、関係の事務連絡(Q&A)を発出しました(平成30年3月13日) |
| 2018年03月22日掲載 | 平成30年4月以降の臨床研究審査員会の認定申請に関する留意事項を掲載しました |
| 2018年03月28日掲載 | 普及促進資材(ポスター・リーフレット)を掲載しました |
| 2018年03月30日掲載 | 認定研究審査委員会について公示しました(平成30年3月30日) |
| 2018年03月30日掲載 | 施行規則に関して読替表を掲載しました |
| 2018年04月03日掲載 | jRCT(Japan Registry of Clinical Trials)について公開しました |
| 2018年04月03日掲載 | 臨床研究法における臨床研究の利益相反管理について、参考資料を掲載しました |
| 2018年04月09日掲載 | 「臨床研究法施行規則の施行等について」の一部訂正について、臨床研究法の施行等に関するQ&Aについて(その2)、臨床研究法の統一書式について を掲載しました(平成30年4月9日) |
| 2018年04月18日掲載 | 厚生労働大臣への疾病等報告について掲載しました |
| 2018年05月17日掲載 | 臨床研究法の施行等に関するQ&Aについて(その3)、臨床研究審査委員会認定事項変更申請について掲載しました(平成30年5月17日) |
| 2018年05月25日掲載 | 利益相反管理に係るガイダンスの様式(ver.2.0)、認定臨床研究審査委員会の初回申請時の統一書式と実施計画の留意事項を掲載しました |
| 2018年06月13日掲載 | 利益相反管理に係るガイダンスの様式(ver.2.1)を掲載しました |
| 2018年06月26日掲載 | 認定臨床研究審査委員会の審査の視点を掲載しました |
| 2018年06月28日掲載 | 臨床研究法の英語訳、実施計画の提出方法等、jRCTのお知らせを掲載しました |
| 2018年07月17日掲載 | 利益相反管理に係るガイダンスの様式(ver.2.2)を掲載しました |
| 2018年07月30日掲載 | 臨床研究法の施行等に関するQ&Aについて(その4)を掲載しました(平成30年7月30日) |
| 2018年08月24日掲載 |
「臨床研究審査委員会審査能力向上促進事業一式」について公告されました(調達情報)
|
臨床研究法について
1.臨床研究法(関係法令)
1-1.臨床研究法(平成29年法律第16号)
臨床研究法が制定されました(平成29年4月14日公布)。
この法律は、平成30年4月1日より施行されました。
1-2.臨床研究法の施行期日を定める政令(平成30年政令第40号)
1-3.臨床研究法第24条第2号の国民の保健医療に関する法律等を定める政令(平成30年政令第41号)
1-4.臨床研究法施行規則(平成30年厚生労働省令第17号)
1-5.臨床研究法の施行に伴う政省令の制定について(平成30年2月28日医政発0228 第10号 厚生労働省医政局長通知)
1-6.臨床研究法施行規則の施行等について(平成30年2月28日医政経発0228第1号 厚生労働省医政局経済課長・医政研発0228第1号 同研究開発振興課長通知)
1-7.臨床研究法における臨床研究の利益相反管理について(平成30年3月2日医政発0302第1号 厚生労働省医政局研究開発振興課長通知)
 全体[1,045KB]
全体[1,045KB]
 参考資料:ガイダンス様式部分のみ(ver.2.2):式・条件付き書式設定版[6151KB]
参考資料:ガイダンス様式部分のみ(ver.2.2):式・条件付き書式設定版[6151KB]
 参考資料:ガイダンス様式部分のみ(ver.2.2):式・条件付き書式解除版[194KB]
参考資料:ガイダンス様式部分のみ(ver.2.2):式・条件付き書式解除版[194KB]
注)すでにver.2.1以前の書式で作成されている場合、ver.2.1以前の書式を利用して頂いても結構です。
 参考資料:臨床研究法における利益相反管理ガイダンスに関するQ&A[39KB]
参考資料:臨床研究法における利益相反管理ガイダンスに関するQ&A[39KB]
 参考資料:臨床研究法における利益相反管理に関する標準業務手順書[27KB]
参考資料:臨床研究法における利益相反管理に関する標準業務手順書[27KB]
1-8.臨床研究に用いる医薬品等の品質の確保に必要な措置について(平成30年3月2日医政発0302第5号 厚生労働省医政局研究開発振興課長通知)
1-9.臨床研究法の統一書式について(平成30年4月9日厚生労働省医政局研究振興課事務連絡)
1-10.臨床研究法の施行等に関するQ&Aについて(その1) (平成30年3月13日厚生労働省医政局研究振興課事務連絡)
1-11.臨床研究法の施行等に関するQ&Aについて(その2) (平成30年4月9日厚生労働省医政局研究振興課事務連絡)
1-12.臨床研究法の施行等に関するQ&Aについて(その3) (平成30年5月17日厚生労働省医政局研究振興課事務連絡)
2.認定臨床研究審査委員会(CRB :Certified Review Board)について
3.実施計画について
臨床研究法に規定する実施計画作成にあたって、ご参照ください。
4.jRCT(Japan Registry of Clinical Trials)について

認定臨床研究審査委員会申請・情報公開システム
臨床研究に関する審査意見業務を行う認定臨床研究審査委員会について、臨床研究法に基づき、厚生労働大臣に対する認定の申請や変更の届出等の手続を行うためのシステムです。
また、認定臨床研究審査委員会が行う審査意見業務の透明性を確保するため、その業務規定・委員名簿などの認定に関する情報や審査意見業務の過程に関する情報を公開しています。
ヘルプデスク:
【内容に関するお問い合わせはこちら】
sec-jcrb☆niph.go.jp (☆を@に代えてご利用ください)
【システムに関する不具合・ご要望はこちら】
webadmin-jcrb☆niph.go.jp (☆を@に代えてご利用ください)
臨床研究実施計画・研究概要公開システム
医療機関等で実施される臨床研究について、臨床研究法の規定に基づき、厚生労働大臣に対して、実施計画の提出などの届出手続を行うためのシステムです。
また、同法に規定する臨床研究実施基準に基づき、世界保健機関(WHO)が公表を求める事項や研究過程の透明性確保及び国民の臨床研究への参加の選択に資する情報について公開しています。
(お知らせ)
1.治験情報については、現在入力環境を整備中です。このため、当面の間は引き続き、国内の臨床試験情報登録センター(JapicCTI、日本医師会臨床試験登録システム等)に登録いただくようお願いいたします。
2.現在、jRCTについては、世界保健機関(WHO)のICTRP(International Clinical Trials Registry Platform)におけるプライマリーレジストリとしての承認を受けるための手続きを進めています。WHOからの承認後、法施行から承認までの間にjRCTに登録されていた研究も含め、ICTRPに登録される予定です。なお、ICMJE(International Committee of Medical Journal Editors)では、WHOのICTRPプライマリーレジストリの情報が受け入れられることとされています。(Regarding the jRCT, we are proceeding with approval from WHO as one of the primary registries of the ICTRP (International Clinical Trials Registry Platform). After the approval, clinical trials registered in the jRCT including the ones that have been already registered since April 1st 2018, will be registered in the ICTRP as well. In addition, according to the ICMJE (International Committee of Medical Journal Editors) website, “the ICMJE will also accept registration in any of the primary registries that participate in the WHO International Clinical Trials Portal”.)
ヘルプデスク:
【内容に関するお問い合わせはこちら】
sec-jrct☆niph.go.jp (☆を@に代えてご利用ください)
【システムに関する不具合・ご要望はこちら】
webadmin-jrct☆niph.go.jp (☆を@に代えてご利用ください)
5.厚生労働大臣への疾病等報告について
臨床研究法に基づき、未承認・適応外の医薬品等を用いる特定臨床研究において、予測できない死亡・重篤な疾病等が発生した場合に、厚生労働大臣(医薬品医療機器総合機構)へ提出する報告書を作成するサービスです。
利用方法については、下記の「ユーザー利用規約」、「ユーザースタートアップマニュアル」をご覧下さい。
厚生労働省医政局研究開発振興課
電話:03-5253-1111(内線4164)
FAX:03-3503-0595