参照元URL : https://www.mhlw.go.jp/haishin/u/l?p=0SohqKnmYisA5stDY
健康・医療新型コロナワクチンの副反応疑い報告について
副反応疑い報告の趣旨
収集した報告について、厚生労働省の審議会に報告し、専門家による評価を行います。こうした結果を公表するなどして、安全性に関する情報提供などを行っていきます。
ワクチンの副反応の評価について
○ワクチンの接種後には副反応を生じることがあり、副反応をなくすことは困難です。接種によって得られる利益と、副反応などのリスクを比較して接種の是非を判断する必要があります。
○副反応疑い報告では、ワクチンと関係があるか、偶発的なもの・他の原因によるものかが分からない事例も数多く報告されます。透明性の向上等のため、こうした事例も含め、報告のあった事例を公表しています。
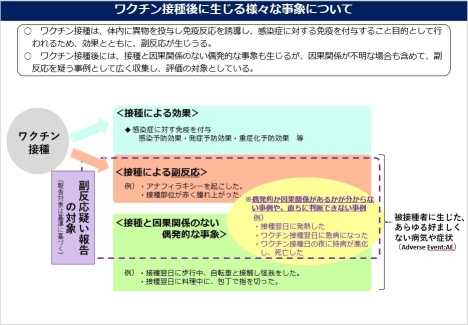
ワクチン接種後に生じる様々な事象について[PDF:795KB]
○日常生活の中では、様々な事象が偶発的に発生しています。ワクチン接種の有無にかかわらず、死亡や急病といった事象も発生しています。接種の後に生じた事象も、それだけでは因果関係があるかどうかが分からないことに注意が必要です。
このため、報告のあった症例について調べるほか、同じような事例の頻度や自然発生と比べて多いかどうか、諸外国における同様の評価の状況などを参考にしながら評価することになります。
※詳しい資料はこちらへ
報告された事例と評価について
新型コロナワクチンの副反応疑い報告の報告状況については、専門家による評価結果とあわせて、速やかに皆さまに情報提供できるよう、審議会(※)を通常より頻繁に開催し、審議会の度に公表することとしています。
(※)厚生科学審議会予防接種・ワクチン分科会副反応検討部会、薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)
▷令和3年10月1日開催 (資料は こちら) New
こちら) New
接種が開始された令和3年2月17日から対象期間の9月12日までに、ファイザー社ワクチン、武田/モデルナ社ワクチンについて副反応疑い報告がなされ、それぞれの頻度は0.02%(122,789,441回接種中22,712例)、0.01%(23,447,233回接種中2,886例)でした。アストラゼネカ社ワクチンについての報告はありません(29,025回接種中0例)でした。いずれのワクチンも、これまでの報告によって、死亡、アナフィラキシー、血小板減少症を伴う血栓症・塞栓症、心筋炎関連事象、年齢・性別別の解析、武田/モデルナ社ワクチンの一部ロットでの異物混入に関する影響の検討を含め、引き続き安全性において重大な懸念は認められないと評価されました。なお、ワクチンにより接種対象者の年齢や接種会場などの属性が大きく異なるため、ワクチン間の単純な比較は困難です。
死亡例の報告について(資料2-3-1、2-3-2、2-3-3、2-7-1、一般社団法人日本循環器学会提出資料)
アナフィラキシーについて(資料2-4-1、2-4-2、2-7-1)
心筋炎・心膜炎について(資料2-7-1、2-7-2、2-7-3、一般社団法人日本循環器学会提出資料)
血小板減少症を伴う血栓症について(資料2-5-1、2-5-2、2-5-3、2-7-1)
異物混入・使用見合わせロットに係る副反応疑い報告について(資料2-6-1、2-6-2、武田薬品工業株式会社提出資料1、武田薬品工業株式会社提出資料2、国立医薬品食品衛生研究所提出資料)
▷令和3年9月10日開催 (資料は こちら)
こちら)
接種が開始された令和3年2月17日から対象期間の8月22日までに、ファイザー社ワクチン、武田/モデルナ社ワクチンについて副反応疑い報告がなされ、それぞれの頻度は0.02%(101,809,021回接種中21,381例)、0.01%(16,501,085回接種中2,075例)でした。アストラゼネカ社ワクチンについての報告はありません(35回接種中0例)でした。いずれのワクチンも、これまでの報告によって、死亡、アナフィラキシー、血小板減少症を伴う血栓症・塞栓症、心筋炎関連事象、年齢・性別別の解析、武田/モデルナ社ワクチンの一部ロットでの異物混入に関する影響の検討を含め、引き続き安全性において重大な懸念は認められないと評価されました。なお、ワクチンにより接種対象者の年齢や接種会場などの属性が大きく異なるため、ワクチン間の単純な比較は困難です。
死亡例の報告について(資料1-3-1、1-3-2、1-7-1)
アナフィラキシーについて(資料1-4-1、1-4-2、1-7-1)
血小板減少症を伴う血栓症について(資料1-5-1、1-7-1)
異物混入・使用見合わせロットに係る副反応疑い報告について(資料1-6-1、1-6-2)
▷以前に行われた審議の概要はこちら
その他の情報
○
 「新型コロナワクチンの副反応について」
「新型コロナワクチンの副反応について」 新型コロナワクチンの接種後に、発熱や痛み、頭痛等の症状が起きた時の対応等をお知らせしています。
○  「新型コロナワクチンの有効性・安全性について」
「新型コロナワクチンの有効性・安全性について」
各ワクチンの臨床試験の結果の概要などをご紹介しています。
○  「新型コロナワクチンの接種後の健康状況調査」
「新型コロナワクチンの接種後の健康状況調査」
先行的に接種を受けた1~2万人の接種後に起きた痛み・発熱などの症状の頻度をご紹介しています。
報道発表資料等
 新型コロナワクチンの接種後のアナフィラキシーとして報告された事例について(1例目)(令和3年3月5日)
新型コロナワクチンの接種後のアナフィラキシーとして報告された事例について(1例目)(令和3年3月5日)•
 新型コロナワクチンの接種後の死亡事例について(1例目)(令和3年3月2日)
新型コロナワクチンの接種後の死亡事例について(1例目)(令和3年3月2日)•
 新型コロナワクチンの接種後の副反応疑い報告の事例について(令和3年2月20日)
新型コロナワクチンの接種後の副反応疑い報告の事例について(令和3年2月20日)
