参照元URL:https://www.mhlw.go.jp/haishin/u/l?p=u1zT7y4CYDI8rd0pY
健康・医療
第一三共社のオミクロン株対応1価ワクチンについて New
特徴
ワクチンの種類
本剤はメッセンジャーRNA(mRNA)ワクチンです。SARS-CoV-2のスパイクタンパク質(ウイルスがヒトの細胞へ侵入するために必要なタンパク質)の設計図となるmRNAを脂質の膜に包んだ製剤になります。本剤を接種し、mRNAがヒトの細胞内に取り込まれると、このmRNAを基に細胞内でウイルスのスパイクタンパク質が産生され、スパイクタンパク質に対する中和抗体産生及び細胞性免疫応答が誘導されることで、SARS-CoV-2による感染症の予防ができると考えられています。
令和5年12月現在、オミクロン株XBB.1.5に対応した1価ワクチン(※)が接種可能です。
- (※)オミクロン株対応1価ワクチンとは、オミクロン株系統のスパイクタンパク質の設計図となるmRNAを有効成分とするワクチンです。
接種対象者
初回接種を完了した、12歳以上の方
接種方法
<追加接種>
通常、1回0.6mLを、三角筋(上腕の筋肉)に筋肉注射という方法で接種します。
接種回数と接種間隔
<追加接種>
・前回の接種完了から3か月以上経過した方から、接種を受けてください。接種は1回に限られます。
・前回までの接種に用いたワクチンの種類にかかわらず、本ワクチンの接種が可能です。
有効性について
ワクチンを受けた人では、ワクチンを受けていない人よりも、新型コロナウイルス感染症を発症した割合が少ないことが分かっています。オミクロン株対応2価ワクチン(従来株/BA.4-5)の臨床試験において中和抗体価の上昇により有効性が確認されていること、オミクロン株に対する有効成分を含むワクチンの非臨床試験のデータからヒトでの免疫応答について一定の予測が可能であることが確認されていることを踏まえ、本剤(オミクロン株対応1価ワクチン)の非臨床試験における追加接種により免疫応答が確認されたこと等から、有効性が期待できると考えられています。
ただし、接種を受けても、発症等を完全に予防できる訳ではありません。ワクチン接種にかかわらず、引き続き、適切な感染防止策を行う必要があります。
臨床試験の概要については、「さらに詳しい情報」をご覧ください。
安全性について
稀に起こる重大な副反応として、ショックやアナフィラキシーがあります。
従来型1価ワクチン(従来株)とオミクロン株対応2価ワクチン(従来株/BA.4-5)の安全性について、これまで実施された臨床試験における副反応の発現状況等から、大きな差が無いことが確認されていることを踏まえ、本剤(オミクロン株対応1価ワクチン)の安全性についても上記の製剤と基本的には同様であり、特段の懸念はないものと考えられています。
また、ごく稀ではあるものの、mRNAワクチン接種後に心筋炎や心膜炎を疑う事例が報告されています。接種後数日以内に胸痛、動悸、息切れ、むくみ等の症状が現れたら医療機関を受診してください。
ごく稀ではあるものの、mRNAワクチン接種後にギラン・バレー症候群が報告されています。接種後、手足の力が入りにくい、しびれ等の症状が現れたら、速やかに医療機関を受診してください。なお、本ワクチンは、新しい種類のワクチンのため、これまでに明らかになっていない症状が出る可能性があります。接種後に気になる症状がある場合は、接種医あるいは身近な医療機関に相談してください。
万が一、ワクチンの接種によって健康被害が生じた場合には、国による  予防接種健康被害救済制度がありますので、お住まいの自治体にご相談ください。
予防接種健康被害救済制度がありますので、お住まいの自治体にご相談ください。
臨床試験等の概要については、「さらに詳しい情報」をご覧ください。
予防接種を受けることができない人、注意が必要な人
下記にあてはまる方は、本ワクチンの接種ができない又は接種に注意が必要です。
当てはまるかどうかや、ワクチンを受けて良いかが、ご不明な方は、その病気を診てもらっている主治医にご相談ください。
また、当てはまると思われる方は、必ず接種前の診察時に医師へ伝えてください。
受けることができない人
- ・明らかに発熱している人(※1)
- ・重い急性疾患にかかっている人
- ・本ワクチンの成分に対し重度の過敏症(※2)の既往歴のある人
- ・上記以外で、予防接種を受けることが不適当な状態にある人
- (※1)明らかな発熱とは通常37.5℃以上を指します。ただし、37.5℃を下回る場合も平時の体温に鑑みて発熱と判断される場合はこの限りではありません。
- (※2)アナフィラキシーや、全身性の皮膚・粘膜症状、喘鳴、呼吸困難、頻脈、血圧低下等、アナフィラキシーを疑わせる複数の症状。なお、前回までの接種でこれらの症状が認められた方は、同一の成分を含むワクチンを用いた追加接種を受けることはできません。
注意が必要な人
- ・抗凝固療法を受けている人、血小板減少症または凝固障害(血友病など)のある人
- ・過去に免疫不全の診断を受けた人、近親者に先天性免疫不全症の方がいる人
- ・心臓、腎臓、肝臓、血液疾患や発育障害などの基礎疾患のある人
- ・過去に予防接種を受けて、接種2日以内に発熱や全身性の発疹などのアレルギーが疑われる症状がでた人
- ・過去にけいれんを起こしたことがある人
- ・本ワクチンの成分(※)に対して、アレルギーが起こるおそれがある人
※本ワクチンの成分
▷有効成分
・MAFB-7256a(オミクロン株XBB.1.5のスパイクタンパク質の受容体結合部位をコードするmRNA)
▷添加物
・T168-1857a:(7R,9Z,26Z,29R)-18-({[3-(ジメチルアミノ)プロポキシ]カルボニル}オキシ)ペンタトリアコンタ-9,26-ジエン-7,29-ジイル=ジアセタート
・コレステロール
・DSPC:1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン
・PEG2000-DMG:1,2-ジミリストイル-rac-グリセロ-3-メチルポリオキシエチレン
・精製白糖
・L-ヒスチジン
・pH調節剤
接種当日の注意事項
・ワクチンは、通常、三角筋(上腕の筋肉)に接種するため、肩を出しやすい服装でお越しください。
ワクチンを受けた後の注意点
・注射した部分は清潔に保つようにし、接種当日の入浴は問題ありませんが、注射した部分はこすらないようにしてください。また、接種後に体調が悪い時は無理をせず、入浴は控える等、様子を見るようにしてください。
・接種当日は、通常の生活は問題ありませんが、激しい運動や過度の飲酒は控えてください。
さらに詳しい情報
有効性について(臨床試験等の概要)
▷追加接種(12歳以上)
オミクロン株対応2価ワクチン(従来株/BA.4-5)の臨床試験において中和抗体の上昇により有効性が確認されたこと(下記を参照)、オミクロン株対応1価ワクチン(XBB.1.5)の非臨床試験において免疫応答が確認されたこと(下記を参照)等を踏まえ、オミクロン株対応1価ワクチン(XBB.1.5)による追加接種の有効性は期待できると考えられています。
<国内における臨床試験>
初回接種及び追加接種を完了した12歳以上の者を対象に、第一三共社のオミクロン株対応2価ワクチン(従来株/BA.4-5)による追加接種の臨床試験において、新型コロナウイルスに対する中和抗体価を評価した結果、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)対して非劣性が検証されました。
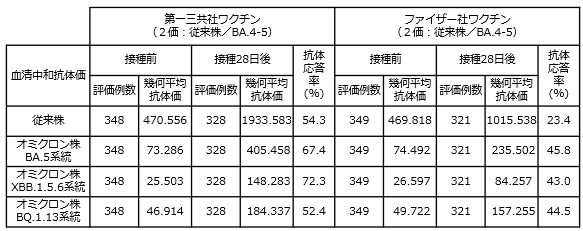
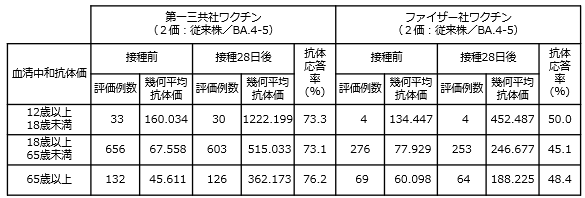
初回接種を完了した18歳以上の者を対象に、第一三共社の従来型1価ワクチン(従来株)による追加接種の臨床試験において、新型コロナウイルスに対する中和抗体価を評価した結果、ファイザー社及びモデルナ社の従来型1価ワクチン(従来株)に対して非劣性が検証されました。
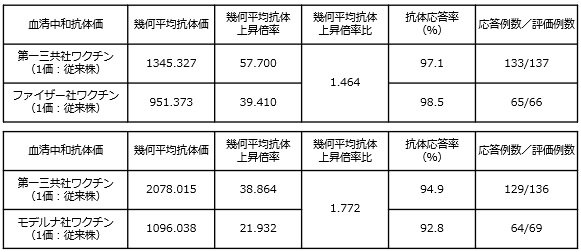
<非臨床試験>
マウスを用いた非臨床試験において、従来型の1価ワクチン(従来株)による初回接種の後にオミクロン株対応1価ワクチン(XBB.1.5)の追加接種を1回行い、接種2週間後にXBB.1.5に対する中和抗体の産生が認められました。
安全性について(臨床試験等の概要)
▷追加接種(12歳以上)
<国内における臨床試験>
第一三共社のオミクロン株対応2価ワクチン(従来株/BA.4-5)の臨床試験における安全性は、ファイザー社のオミクロン株対応2価ワクチン(従来株/BA.4-5)と差異が認められず、既承認の従来型1価ワクチン(従来株)の臨床試験で認められた安全性プロファイルと同様と考えられること(下記を参照)等を踏まえ、既承認の従来型1価ワクチン(従来株)を改変したオミクロン株対応1価ワクチン(XBB.1.5)による追加接種の安全性は許容可能と考えられています。
《接種後28日間に発現した主な副反応》
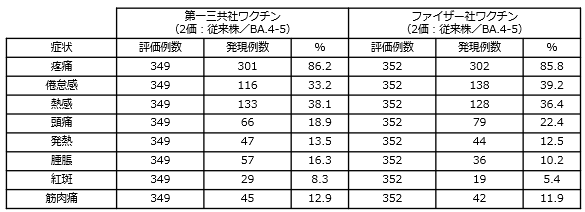
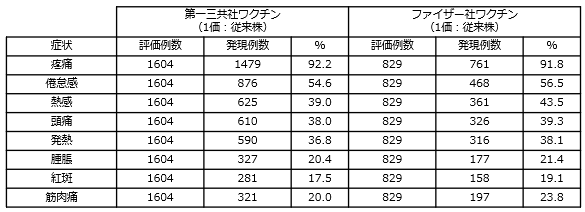
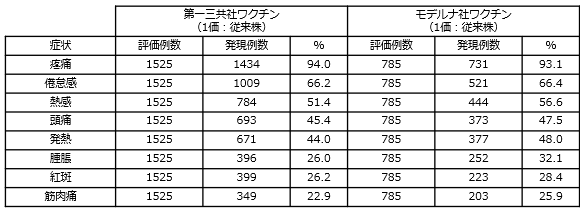
- 詳細(添付文書等)についてはこちらをご覧ください。(独立行政法人 医薬品医療機器総合機構(PMDA)のホームページ)
