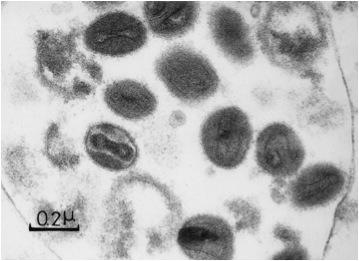
病原体の特徴
エムポックス(サル痘)の病原体は、サル痘ウイルスで、ポックスウイルス科オルソポックスウイルス属に分類される約200kbpの二本鎖DNAをゲノムとする。ウイルスの形態はレンガ状で、その長径は300nmを越える巨大なウイルスである(図1)。サル痘ウイルスには、強毒なコンゴ盆地型とやや弱毒な西アフリカ型があり遺伝的にも識別できる。サル痘ウイルスは、アフリカのジリス等の齧歯類が自然宿主とし、ヒト、サル、プレーリードック、ウサギ等が感染すると、天然痘様の症状を呈することがある。天然痘ウイルス、牛痘ウイルス、ワクチニアウイルス等もオルソポックスウイルス属に含まれる。オルソポックスウイルス間では、抗原性の交叉が非常に強いため、血清診断による感染ウイルス種の同定はできない。このため、遺伝子診断が有力な診断法となる。
ヒトのサル痘は、1970年にザイールで天然痘様疾患として初めて報告され、その後、中央・西アフリカの主に熱帯雨林で散発的に流行している。WHOによると、1981〜1986年のエムポックス(サル痘)患者発生数は338名である。1996〜1997 年にかけてコンゴ民主共和国での流行では患者発生数は511名と報告されている。その後もコンゴ民主共和国では流行している。アフリカ大陸以外にはサル痘ウイルス保有動物はいないが、2003年に米国でガーナから輸入されたサル痘ウイルス感染愛玩用齧歯類齧歯類(サバンナオニネズミ、アフリカヤマネ)からプレーリードッグに感染が広がり、これを感染源とする流行により71名のサル痘患者が発生した。この流行では、病原ウイルスが弱毒な西アフリカ型であったため、死亡例は発生していない。サル痘ウイルスのヒトへの主な感染経路は、感染動物による咬傷、感染動物の血液・体液・皮膚病変等との接触による。サル痘の致死率は1〜10%程度で、患者からの二次感染率は数%程度である。
日本でのアフリカからの輸入禁止齧歯類は、ラッサウイルスの自然宿主であるマストミスのみであるため、輸入感染症としてだけではなく輸入動物を介した患者が発生する可能性は否定できない。
2022年5月に英国及び米国で国内感染例が確認され、その後欧米での流行が見られた。日本では2023年に入り、国内感染事例が確認されている。報告例はMSM(men who have sex men)が主なポピュレーションであり、半数がPWH(people with HIV)であり、性行為を介して伝播している。西アフリカ型が起源であり、軽症例が大部分であるが、免疫不全者では高い致死率であり、最終的な報告が待たれる。直接の接触感染が主な感染経路で、性行為であるということから、皮疹の出現パターンなどは、アフリカ諸国でのこれまでの臨床像と異なるが、急性ウイルス感染症であり、基本的な病態は異なるものではない。バイオテロや新規の流行起こった場合、感染経路に依存しうる、皮疹の出現場所やパターンにこだわることなく考える必要がある。
主な臨床像
潜伏期間は7〜21日(平均12日)で、発疹、発熱、発汗、頭痛、悪寒、咽頭痛、リンパ節腫脹が現れる。発疹は、水疱、膿疱、痂皮へと進行する。重症例では天然痘と臨床的に区別できない (図2)。2022年度からのMSM(men who have sex with men)間でヒトーヒト間で流行したケースからは接触部位に発疹が出現している。サル痘に特徴的な所見としては、リンパ節腫脹が患者に共通に認められる。
臨床検査所見
サル痘ウイルス感染症に特異的検査所見はないが、急性期リンパ球数の減少や、異型リンパ球数の増多など、初感染時の急性ウイルス感染症を認めることが多い(1)。
確定診断
国立感染症研究所のウェブサイトにて病原体マニュアルが公開されている。
上述したように血清診断では感染したオルソポックスウイルス種を同定できないため、確定診断は病原診断による。水疱、膿泡、血液、リンパ節等からのサル痘ウイルス分離による病原体の検出あるいは、PCR法やLoop- Mediated Isothermal Amplification (LAMP) 法による病原体の遺伝子の検出が行われる。これらの遺伝子検出法では、強毒型のコンゴ盆地型とより弱毒な西アフリカ型の鑑別も可能である(2,3)。
治療
シドフォビル、シドフォビルの誘導体で経口投与可能なhexadecloxypropyl-cidofovir (CMX001, Chimerix Inc.)、 ポックスウイルスの細胞外感染性ウイルス粒子形成の阻害剤であるSIGA-246 (SIGA Technologies)等が、最も有望な抗ウイルス薬と考えられていて(4,5,6)、米国で臨床治験が行われていた。2022年ではシドフォビル Tcovirmat, Brincidofovirが、欧州で承認されている。日本で承認されている特異的治療薬はない。Tcovirmatは2018年に天然痘の治療薬としてFDAで承認されている、
2022年の複数の非エンデミック国におけるアウトブレイクにのため、2022年6月29日Tcovirmatを特定臨床研究として投与できる体制を準備している。必要時は国立国際研究医療センターへ相談する。
予防(ワクチン)
天然痘のワクチンである痘そうワクチンがエムポックス(サル痘)にも有効である(7)。感染数日以内ならば治療的に使用しても効果が認められると考えられる。しかし、痘そうワクチンは市販されていないためサル痘の予防用としての適用はない。日本では、1968年以前の出生者は2から3回の種痘歴があり、1969から1975年の出生者では1回の種痘対象となっている。1回種痘対象者の接種率は70%程度であった。1976年以降の出生者は種痘対象外のため免疫がない。種痘の免疫持続期間は不明であるが、日本人の約1,000名の抗体調査では、2回以上の種痘歴がある場合、種痘後30年以上経過しても高率に抗体が保持されていた(8)。さらに、ウイルス特異的メモリーT細胞は種痘後数十年後でも高率に維持されている(9)
2022年の流行に関して、天然痘ワクチンの曝露後予防を、一部の対象者に対して、国立国際医療研究センター等で実施しており、曝露するようなことがあれば、最新の情報を取り入れ対応する必要がある。
2022年の流行では4-18%で過去の天然痘ワクチン接種者における感染症が確認されており (10,11,12)、国内でも定期接種世代(1975年度生まれ以前)で感染者が確認されている (13)。
バイオハザード対策
サル痘ウイルスの取扱いは、国立感染症研究所の安全管理規程ではBSL2(ABSL3)であるが、これに加えて、感染症法による施設の基準(感染症法第56条の24)を満たしていなければならない。
感染症法における取り扱い
エムポックス(サル痘)は、感染症法で4類感染症に指定されている。診察あるいは検案した医師の判断により、患者(確定例:症状や所見からサル痘が疑われ、確定検査によって病原体の診断がされた場合)、無症状病原体保有者(臨床的特徴を呈していないが、確定検査により、病原体の診断がされた場合)、感染症死亡者の死体(症状や所見からサル痘が疑われ、確定検査によって病原体の診断がされた場合)、感染症死亡疑い者の死体(症状や所見から、サル痘により死亡したと疑われる場合)と診断された場合、法第12条第1項の規定による届出を直ちに行わなければならない。
また、サル痘ウイルスは、感染症法(政令)で3種病原体に指定されているため、ウイルスを所持する場合は、感染症法第56条の16による所持の届出が必要となる。また、運搬にあたっては感染症法第56条の27により都道府県公安委員会への届出が必要となる。
最新の扱いについては、厚生労働省の該当ページをご参照ください。
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou/kekkaku-kansenshou19/monkeypox_00001.html
参考文献
- 1. Adachi E, Saito M, Otani A, Koga M, Yotsuyanagi H: Transient decrease in T cells and atypical lymphocyte proliferation after the onset of mpox. J Med Virol. 2023 Aug;95(8):e29021
- 2. Saijo M, Ami Y, Suzaki Y, Nagata N, Iwata N, Hasegawa H, Ogata M, Fukushi S, Mizutani T, Iizuka I, Sakai K, Sata T, Kurata T, Kurane I, Morikawa S. Diagnosis and assessment of monkeypox virus (MPXV) infection by quantitative PCR assay: differentiation of Congo Basin and West African MPXV strains. Jpn J Infect Dis. 61(2):140-2, 2008
- 3. Iizuka I, Saijo M, Shiota T, Ami Y, Suzaki Y, Nagata N, Hasegawa H, Sakai K, Fukushi S, Mizutani T, Ogata M, Nakauchi M, Kurane I, Mizuguchi M, Morikawa S. Loop-mediated isothermal amplification-based diagnostic assay for monkeypox virus infections. J Med Virol. 81(6):1102-8, 2009
- 4. Stittelaar KJ, Neyts J, Naesens L, van Amerongen G, van Lavieren RF, Holý A, De Clercq E, Niesters HG, Fries E, Maas C, Mulder PG, van der Zeijst BA, Osterhaus AD. Antiviral treatment is more effective than smallpox vaccination upon lethal monkeypox virus infection. Nature 439(7077):745-8, 2006
- 5. Parker S, Touchette E, Oberle C, Almond M, Robertson A, Trost LC, Lampert B, Painter G, Buller RM. Efficacy of therapeutic intervention with an oral ether-lipid analogue of cidofovir (CMX001) in a lethal mousepox model. Antiviral Res. 77(1):39-49, 2008
- 6. Grosenbach DW, Berhanu A, King DS, Mosier S, Jones KF, Jordan RA, Bolken TC, Hruby DE. Efficacy of ST-246 versus lethal poxvirus challenge in immunodeficient mice. Proc Natl Acad Sci U S A. 107(2):838-43, 2010
- 7. Saijo M, Ami Y, Suzaki Y, Nagata N, Iwata N, Hasegawa H, Ogata M, Fukushi S, Mizutani T, Sata T, Kurata T, Kurane I, and Morikawa S : LC16m8, a highly attenuated vaccinia virus vaccine lacking expression of the membrane protein B5R, protects monkeys from monkeypox. J Virol. 80(11):5179-88, 2006
- 8. Hatakeyama S, Moriya K, Saijo M, Morisawa Y, Kurane I, Koike K, Kimura S, and Morikawa S : Persisting humoral antiviral immunity within the Japanese population after the discontinuation in 1976 of routine smallpox vaccinations. Clin Diagn Lab Immunol. 12(4):520-4, 2005.
- 9. Hammarlund E, Lewis MW, Hansen SG, Strelow LI, Nelson JA, Sexton GJ, Hanifin JM, Slifka MK.: Duration of antiviral immunity after smallpox vaccination. Nat. Med. 9: 1131–1137, 2003
- 10. Thornhill JP, Barkati S, Walmsley S, Rockstroh J, Antinori A, Harrison LB, Palich R, Nori A, Reeves I, Habibi MS, Apea V, Boesecke C, Vandekerckhove L, Yakubovsky M, Sendagorta E, Blanco JL, Florence E, Moschese D, Maltez FM, Goorhuis A, Pourcher V, Migaud P, Noe S, Pintado C, Maggi F, Hansen AE, Hoffmann C, Lezama JI, Mussini C, Cattelan A, Makofane K, Tan D, Nozza S, Nemeth J, Klein MB, Orkin CM; SHARE-net Clinical Group.: Monkeypox Virus Infection in Humans across 16 Countries – April-June 2022. N Engl J Med. 2022 Aug 25;387(8):679-691
- 11. Hazra A, Zucker J, Bell E, Flores J, Gordon L, Mitjà O, Suñer C, Lemaignen A, Jamard S, Nozza S, Nori AV, Pérez-Barragán E, Rodríguez-Aldama JC, Blanco JL, Delaugerre C, Turner D, Fuertes I, Leiro V, Walmsley SL, Orkin CM; SHARE-NET writing group.: Mpox in people with past infection or a complete vaccination course: a global case series. Lancet Infect Dis. 2023 Sep 4:S1473-3099(23)00492-9
- 12. Tarín-Vicente EJ, Alemany A, Agud-Dios M, Ubals M, Suñer C, Antón A, Arando M, Arroyo-Andrés J, Calderón-Lozano L, Casañ C, Cabrera JM, Coll P, Descalzo V, Folgueira MD, García-Pérez JN, Gil-Cruz E, González-Rodríguez B, Gutiérrez-Collar C, Hernández-Rodríguez Á, López-Roa P, de Los Ángeles Meléndez M, Montero-Menárguez J, Muñoz-Gallego I, Palencia-Pérez SI, Paredes R, Pérez-Rivilla A, Piñana M, Prat N, Ramirez A, Rivero Á, Rubio-Muñiz CA, Vall M, Acosta-Velásquez KS, Wang A, Galván-Casas C, Marks M, Ortiz-Romero PL, Mitjà O: Clinical presentation and virological assessment of confirmed human monkeypox virus cases in Spain: a prospective observational cohort study. Lancet. 2022 Aug 27;400(10353):661-669. 2003
- 13. Adachi E, Ikeuchi K, Otani A, Saito M, Koga M, Yotsuyanagi H.: Mpox associated with Panton-Valentin leucocidin-producing methicillin-resistant Staphylococcus aureus among people with HIV J Infect Chemother. 2023 Jul;29(7):710-712.
画像
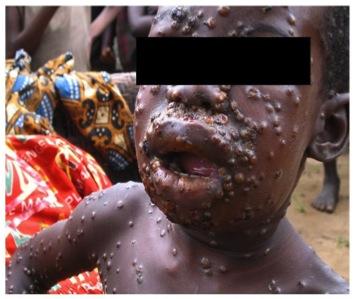 図2 ヒトサル痘患者.
図2 ヒトサル痘患者.
Dr. Muyembe-Tamfum JJより